Tā kā laboratorijā ir jauns, tas nav labs darbs izsijāt pozitīvos augus no augu ķekara ar zemu konversijas koeficientu.Pirmkārt, DNS ir jāizņem no liela skaita paraugu pa vienam, un tad svešie gēni tiks atklāti ar PCR.Tomēr rezultāti bieži vien ir tukši un joslas ar dažiem vienumiem reizēm, bet nav iespējams noteikt, vai ir nokavēti vai nepatiesi..Vai ir ļoti bezpalīdzīgi stāties pretī šādam eksperimentālam procesam un rezultātiem?Neuztraucieties, brālis māca, kā viegli un precīzi izsijāt transgēnos pozitīvos augus.
1. darbība
Dizaina noteikšanas grunti
Nosakiet nosakāmo endogēno gēnu un eksogēno gēnu atbilstoši pārbaudāmajam paraugam un atlasiet gēnā reprezentatīvu 100–500 bp secību praimera projektēšanai.Labi primeri var nodrošināt noteikšanas rezultātu precizitāti un saīsināt noteikšanas laiku (plašāk izmantotos noteikšanas primerus skatiet pielikumā).
Piezīme: Jaunizveidotajiem primeriem ir jāoptimizē reakcijas apstākļi un jāpārbauda noteikšanas precizitāte, precizitāte un noteikšanas robeža pirms liela mēroga noteikšanas.
2. darbība
Dizaina eksperimentālais protokols
Pozitīva kontrole: izmantojiet attīrīto DNS, kas satur mērķa fragmentu, kā veidni, lai noteiktu, vai PCR reakcijas sistēma un apstākļi ir normāli.
Negatīvā/tukšā kontrole: izmantojiet DNS veidni vai ddH2O, kas nesatur mērķa fragmentu, kā veidni, lai noteiktu, vai PCR sistēmā nav piesārņojuma avota.
Iekšējā atsauces kontrole: izmantojiet testējamā parauga endogēnā gēna praimera/zondes kombināciju, lai novērtētu, vai veidni var noteikt ar PCR.
Paziņojums:
Katram testam jāiestata pozitīvās, negatīvās/tukšās kontroles un iekšējās kontroles kontroles, lai novērtētu eksperimenta rezultātu derīgumu.
Eksperimenta sagatavošana
Pirms lietošanas pārbaudiet, vai šķīdums ir vienmērīgi sajaukts.Ja tiek konstatēti nokrišņi, pirms lietošanas tie ir jāizšķīdina un jāsamaisa saskaņā ar instrukcijām.2×PCR maisījums pirms lietošanas jāiepilina ar pipeti un atkārtoti jāsamaisa ar mikropipeti, lai izvairītos no nevienmērīga jonu sadalījuma.
Paziņojums:
Izņemiet rokasgrāmatu un uzmanīgi izlasiet to, un pirms eksperimenta sagatavojieties stingri saskaņā ar rokasgrāmatas prasībām.
4. darbība
Sagatavojiet PCR reakcijas sistēmu
Saskaņā ar eksperimentālo protokolu vienmērīgi samaisiet primerus, H2O un 2 × PCR, centrifugējiet un sadaliet katrā reakcijas mēģenē.
Paziņojums:
Liela mēroga vai ilgtermiņa testēšanai ieteicams izmantot UNG enzīmu saturošu PCR reakcijas sistēmu, kas var efektīvi izvairīties no PCR produktu izraisīta aerosola piesārņojuma.
5. darbība
Pievienojiet reakcijas veidni
Izmantojot Direct PCR tehnoloģiju, nav nepieciešams nogurdinošs nukleīnskābju attīrīšanas process, parauga šablonu var sagatavot 10 minūšu laikā un pievienot atbilstošo PCR reakcijas sistēmu.
Paziņojums:
Šķelšanas metodei ir labāks noteikšanas efekts, un iegūto produktu var izmantot vairākām noteikšanas reakcijām.
5.1: Tieša lapu izplešanās
Atbilstoši rokasgrāmatā redzamā attēla izmēram nogrieziet lapu audus ar diametru 2-3 mm un ievietojiet to PCR reakcijas sistēmā.
Piezīme. Pārliecinieties, ka lapu fragmenti ir pilnībā iegremdēti PCR reakcijas šķīdumā, un nepievienojiet pārmērīgu lapu audu.
5.2.: lapu sadalīšanas metode
Izgrieziet lapu audus ar diametru 5-7 mm un ievietojiet to centrifūgas mēģenē.Ja izvēlaties nobriedušas lapas, lūdzu, nelietojiet lapas galvenās vēnas audus.Pipetējiet 50 ul buferšķīduma P1 lizātu centrifūgas mēģenē, lai nodrošinātu, ka lizāts var pilnībā iegremdēt lapu audus, ievietot to termiskajā ciklā vai metāla vannā un lizēt 95 °C temperatūrā 5–10 minūtes.
Pievienojiet 50 ul buferšķīduma P2 neitralizācijas šķīdumu un labi samaisiet.Iegūto lizātu var izmantot kā veidni un pievienot PCR reakcijas sistēmai.
Piezīme. Veidnes daudzums ir no 5-10% no PCR sistēmas, un tas nedrīkst pārsniegt 20% (piemēram, 20 μl PCR sistēmā pievienojiet 1-2 μl līzes šķīduma, ne vairāk kā 4 μl).
6. darbība
PCR reakcija
Pēc PCR reakcijas mēģenes centrifugēšanas to ievieto PCR instrumentā pastiprināšanai.
Paziņojums:
Reakcijā amplifikācijai tiek izmantots neattīrīts šablons, tāpēc amplifikācijas ciklu skaits ir par 5-10 cikliem vairāk nekā tad, ja tiek izmantota attīrīta DNS veidne.
7. darbība
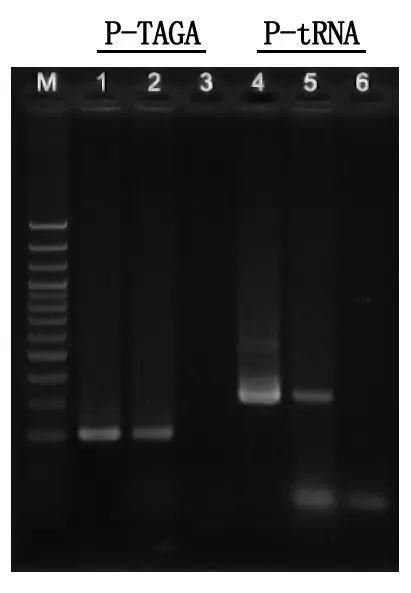
Elektroforēzes noteikšana un rezultātu analīze
M: 100 bp DNS kāpnes
1\4: attīrītas DNS metode
2\5: tiešā PCR metode
3\6: tukša vadīkla
QC:
Eksperimentā iestatīto dažādo kontroles testu rezultātiem jāatbilst šādiem nosacījumiem.Pretējā gadījumā ir jāanalizē problēmas cēlonis un pēc problēmas novēršanas pārbaude jāveic vēlreiz.
1. tabula. Dažādu kontroles grupu normālie testu rezultāti
*Ja plazmīdu izmanto kā pozitīvu kontroli, endogēno gēnu testa rezultāts var būt negatīvs
Rezultāta spriedums:
A. Parauga endogēnā gēna testa rezultāts ir negatīvs, kas norāda, ka no parauga nevar iegūt parastai PCR noteikšanai piemērotu DNS vai ekstrahētā DNS satur PCR reakcijas inhibitorus, un DNS ir jāizņem vēlreiz.
B. Parauga endogēnā gēna testa rezultāts ir pozitīvs, bet eksogēnā gēna testa rezultāts ir negatīvs, kas liecina, ka no parauga tiek iegūta parastajai PCR noteikšanai piemērota DNS, un var spriest, ka paraugā nav konstatēts XXX gēns.
C. Parauga endogēnā gēna testa rezultāts ir pozitīvs, bet eksogēnā gēna testa rezultāts ir pozitīvs, kas norāda, ka no parauga ir iegūta parastai PCR noteikšanai piemērota DNS un parauga DNS satur XXX gēnu.Apstiprinājuma eksperimentus var veikt tālāk.
8. darbība
Dizaina noteikšanas grunti
Pēc eksperimenta izmantojiet 2% nātrija hipohlorīta šķīdumu un 70% etanola šķīdumu, lai noslaucītu eksperimentālo zonu, lai novērstu vides piesārņojumu.
Izlikšanas laiks: 08.09.2021